

化学所在蛋白质化学修饰与细胞输送研究方面取得新进展
蛋白质是生命活动的主要执行者,其对生命过程的调控多通过种类复杂、时空分辨的化学修饰实现。设计对细胞微环境具有响应性的化学修饰蛋白可以在分子水平上揭示蛋白质调控生命过程的化学本质,并发展疾病诊断和治疗的分子工具。
在国家自然科学基金委、科技部和中国科学院的支持下,中科院活体分析化学重点实验室汪铭课题组围绕蛋白质的化学修饰和细胞输送开展研究,发展了系列对细胞微环境具有刺激响应性的蛋白质化学修饰新方法(Acc. Chem. Res., 2019, 52, 665-675)。最近,他们设计了还原性细胞微环境响应的蛋白质化学修饰方法,并利用肿瘤细胞内高浓度的还原性物质(如还原性谷胱甘肽等)调控核糖核酸酶(RNase A)的化学修饰,实现了蛋白质活性的细胞原位激活(Chem. Commun., 2019, 55, 5163-5166),并有望用于发展疾病靶向治疗新策略。
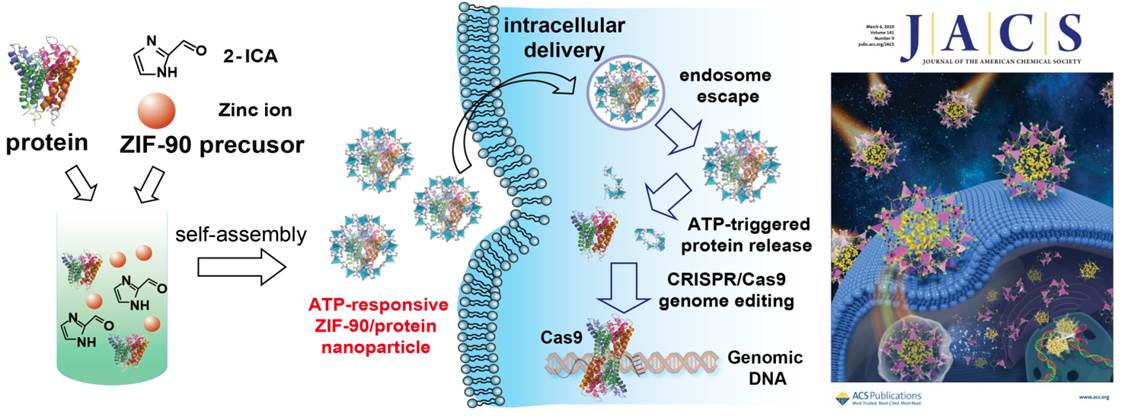
同时,面对蛋白质稳定性差且难以穿透细胞膜的挑战,他们与实验室于萍研究员等合作,通过调控金属-有机框架材料(ZIF-90)和蛋白质的组装,发展了蛋白质细胞输送和化学修饰调控新策略。他们发现,通过主客体化学作用,ZIF-90可携带小分子进入细胞,并对细胞内ATP具有响应性,进而实现了细胞ATP的选择性实时荧光成像(J. Am. Chem. Soc., 2017, 139, 5877-5882)。在此基础上,他们发展了具有普适性的ZIF-90和蛋白质组装新方法,制备了多种ZIF-90和蛋白质纳米颗粒,包括绿色荧光蛋白(GFP),核糖核酸酶A (RNase A), 超氧化物歧化酶(SOD)和基因编辑蛋白(Cas9)等。研究发现,上述纳米颗粒可高效输送多种蛋白质进入细胞,并在细胞内ATP的作用下释放蛋白质,进而实现了由细胞内活性氧调控和激活化学修饰蛋白。基于上述原理和方法,他们发展了ATP调控的CRISPR/Cas9基因编辑蛋白细胞输送和基因编辑新方法,为进一步探索CRISPR/Cas9基因编辑的化学生物学和生物医学应用提供了新工具。相关研究成果发表在近期J. Am. Chem. Soc.(2019,141(9), 3782-3786),并入选杂志封面。
活体分析化学院重点实验室
2019年7月9日
附件下载: