

张德清课题组与赵睿课题组合作在促进肿瘤细胞凋亡的分子开关研究方面取得新进展
作为智能探针,活性动态可控的分子开关是研究和干预生命过程的有利工具。光作为一种非侵入性的控制参数,具有高度正交性和时空精度,在调控分子功能中具有独特优势。常用光开关分子(如:偶氮苯和二芳基乙烯等)存在响应波长短、调控方式单一、缺乏分子靶标等问题,制约了它们在生命体系中的应用。
在国家自然科学基金委、科技部和中国科学院的支持下,化学所有机固体院重点实验室张德清研究员课题组和活体分析化学院重点实验室赵睿研究员课题组合作,开展了以四苯乙烯为关键骨架的靶向生物探针方面的研究。在前期研究工作中,研究人员设计合成了具有不同长度烷基侧链的四苯乙烯吡啶盐分子,研究了它们与蛋白靶标的相互作用,进而构建了线粒体自噬过程的新探针,通过自噬干预新策略,实现了对高恶性脑肿瘤细胞增殖的有效抑制(Angew. Chem. Int. Ed. 2020, 59, 10042-10051)。
最近,两个课题组共同设计合成了具有顺-反异构转化的四苯乙烯化合物(T-P),该分子不仅具有可见光响应的顺反异构特性,而且在生物体系中,其顺-反异构比率受白蛋白的影响:cis T-P与白蛋白形成紧密结合的复合物,在光致异构后成为稳定存在的主要构型。进一步研究发现,T-P特异性识别肿瘤细胞标志物碱性磷酸酶(ALP)并发生水解,生成具有促进细胞凋亡的产物。通过解析T-P分子空间构型与生物活性的构效关系,提出了利用可见光和体内蛋白靶标动态变化抑制或激活细胞凋亡的新策略(图1)。在血液递送过程中,T-P与白蛋白形成稳定复合物,降低了生物毒性。在ALP高表达的肿瘤部位,T-P从白蛋白复合物切换为ALP结合状态,特异性进入并损伤癌细胞。利用光触发的顺反异构和环境白蛋白含量变化,实现了cis T-P抗肿瘤活性的原位激活和trans T-P细胞毒性的按需调节,为构建活性动态可控的新型光功能分子提供了新思路,可望为肿瘤精准治疗提供新策略。相关研究成果近期发表于Angew. Chem. Int. Ed.(2022,61, e202208378),文章的第一作者是黄嫣嫣副研究员,通讯作者是张德清研究员和赵睿研究员。
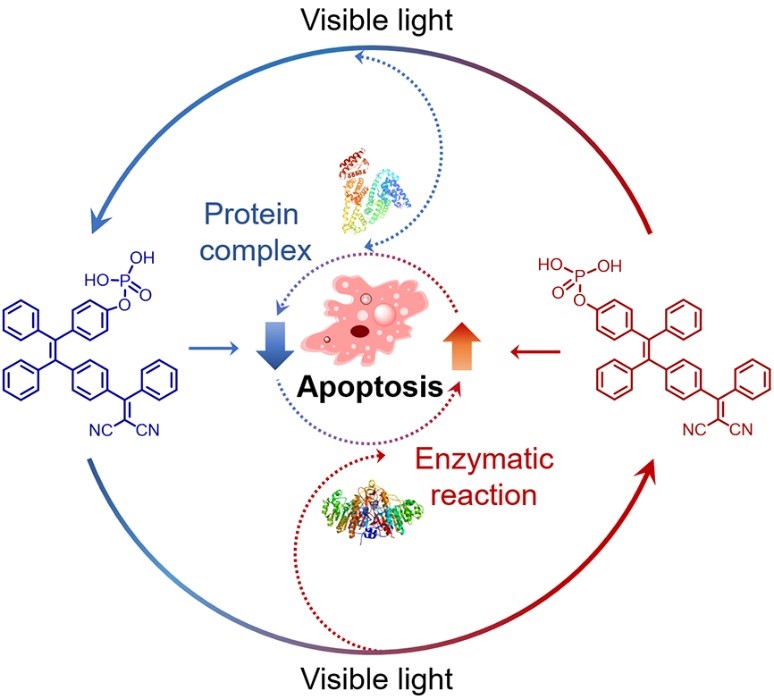
图1 可见光和蛋白靶标多重响应的顺反异构体用于肿瘤细胞凋亡调控
有机固体院重点实验室
2022年9月5日
附件下载: