

化学所在细胞信号转导相关蛋白的单分子实时成像和表征研究方面取得重要进展
单分子技术是20世纪末迅速发展起来的新技术。目前,生物体系中的单分子研究尤其是活细胞中单个生物分子动态行为的原位实时探测已成为单分子技术发展的主要目标和前沿方向。
化学研所分子纳米结构与纳米技术院重点实验室研究人员在国家自然科学基金委重大研究计划、科技部纳米科学重大科学研究计划和中科院等相关项目的支持下,长期致力于活细胞体系单分子原位、实时成像和表征方法的研究,建立了可用于细胞信号通路相关膜蛋白受体激活、内吞和配受体结合等研究的活细胞单分子荧光成像和单分子力谱法(J. Phys. Chem. B 2008, 112: 4140-4145;2006,110, 19647-19651. Exp. Cell. Res. 2009,315,2847-55; 2007, 331, 3497-3504)。 近期与清华大学生物系合作,通过活细胞单分子成像,在转化生长因子受体聚集状态和激活模式的研究方面取得重要进展,相关研究成果发表于2009年美国科学院院刊(Proc. Natl. Acad. Sci. USA, 106, 15679-15683, 2009)。
转化生长因子TGF-β信号通路在细胞增殖、分化、凋亡和个体发育过程中发挥重要作用,并与癌症等多种疾病的发生发展紧密相关。信号转导发生的第一步是配体TGF-β与细胞膜上特异受体结合以激活受体。TGF-β受体属于丝氨酸/苏氨酸激酶受体。生物学已建立信号转导通路模型认为这类受体在静息状态下以同源二聚体或寡聚体形式存在,在配体TGF-β刺激下与I型受体发生异聚而激活。这与另一类典型生长因子受体--酪氨酸激酶受体所普遍具有的配体诱导单体发生二聚的激活模型形成鲜明对比。但是受研究手段的限制,以往关于TGF-β受体激活前后聚集状态的研究结果都是在过量表达受体和离体(细胞破碎)的条件下得到的,是否能反映生理状态下受体的聚集状态一直存有疑问。
研究人员运用单分子荧光成像技术,控制受体在细胞膜上的表达量,实现了细胞膜上单个TGF-β受体的实时成像。通过对TGF-βII型受体单分子荧光强度和单分子荧光漂白步数的统计,发现该受体静息状态下主要以单体形式存在,配体刺激后二聚体的比例显著增加。同时还发现这种二聚体的形成并不受细胞是否表达TGF-βI型受体的影响。表明TGF-βII型受体与表皮生长因子受体EGFR等酪氨酸激酶一样,具有配体诱导单体二聚的激活方式。对于处于静息状态的细胞,当受体表达量增加时,能形成二聚体等寡聚体。这解释了为何以往基于过量表达受体的生化研究结果没有发现II型受体的单体形式,而认为II型受体等例外地在激活前就以二聚体形式存在。综合这些结果,研究人员提出配体诱导单体发生二聚的受体激活模型对于TGF-βII型受体这种丝氨酸/苏氨酸激酶类受体仍然适用的新观点。
活细胞单分子成像和示踪为研究细胞信号转导的分子机制提供了新的途径。

图1 细胞膜上绿色荧光蛋白标记TGF-βII型受体的单分子图像
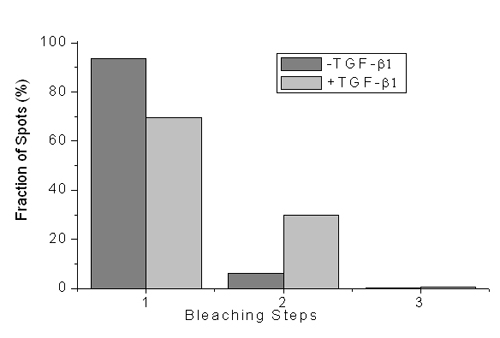
图2 受体荧光漂白步数的变化提示刺激后二聚体比例增加
分子纳米结构与纳米技术实验室
2010年1月11日
附件下载: