

化学所在活细胞分子探针方面取得系列进展
分子识别是生命过程的基础,揭示生物活性分子间识别作用是透彻理解生命过程的重要途径。发展新型识别分子、构筑分子探针,在分子水平上探索生命过程和疾病发生发展机制是现代生化分析领域前沿研究方向之一。
中科院化学所活体分析化学院重点实验室的相关科研人员长期致力于分子探针的开发和分子识别机制的研究,并取得一系列研究成果(Anal. Chem., 2014 86, 7063-7070;Biomaterials,2014 35, 6998-7007;Anal. Chem.,2014 86, 2289–2296; Anal. Chem.,2014 86, 943–952; Chem. Sci.,2015 6, 3831-3838; Mol Cell Proteomics., 2015 14,2692-700; Chem. Eur. J., 2016 22, 6037–6047; Chem. Eur. J., 2016 22, 4015–4021)。
最近,在科技部、国家自然科学基金委和中科院的大力支持下,研究人员在活细胞分子探针研究方面取得系列进展。
线粒体是细胞的能量工厂,其功能还涉及细胞代谢、信号传导、分化、生长、凋亡和死亡等重要过程。线粒体自噬(mitophagy)是细胞清除损伤或衰老的线粒体并循环利用其组成元素的过程;与衰老、神经退行性疾病和癌症等诸多生理病理过程密切相关。对线粒体自噬过程的监测对相关研究具有重要意义。目前主要是采用抗体或荧光蛋白标记的方法检测自噬相关蛋白,或以线粒体荧光探针加溶酶体荧光探针共同检测相关过程。前者操作复杂,在活细胞中的应用受到限制;后者特异性较低。
基于此,研究人员设计了以花菁为母体的近红外荧光探针分子HQO。HQO可进入活细胞并选择性富集于线粒体;当线粒体发生自噬形成自噬溶酶体后其微环境pH下降,导致HQO质子化。质子化后HQO的荧光激发和发射波长均发生红移(>100 nm),使得HQO在线粒体和自噬溶酶体中呈现不同颜色荧光,因而可以很好地区分线粒体和自噬溶酶体。该探针可精确定位线粒体,准确示踪线粒体自噬过程,相关结果发表在J. Am. Chem. Soc. 2016 138 12368–12374。

图1 探针HQO和HQO示踪活细胞线粒体自噬过程原理图
细胞间通讯对细胞正常生理活动至关重要,也与肿瘤发生发展过程密切相关。近年来研究发现细胞间的一类隧道纳米管类似结构(tunneling nanotube,TNT)能够介导细胞通讯,但其形成机制和生物学功能尚无统一定论。因此,发展特异识别这种细胞间通讯结构的分子探针有助于理解细胞间信息传递过程。
研究人员利用基于活细胞的指数富集配基系统进化技术(Cell-SELEX)筛选得到了能与耐药肿瘤细胞MCF-7R高特异性、强亲和力结合的核酸适配体(aptamer)。以该核酸适配体构建的分子探针能够选择性识别细胞间隧道纳米管类似结构。同时发现该结构不仅在耐药肿瘤细胞间形成,也可在耐药与非耐药细胞间形成,并可在耐药和非耐药细胞间运输耐药相关蛋白,说明该细胞间结构可能是肿瘤耐药性传染的途径之一。新构建的分子探针为研究胞间连接介导细胞通讯提供了新的手段和途径,相关结果发表于Angew. Chem. Int. Ed. 2016 55, 3914–3918。
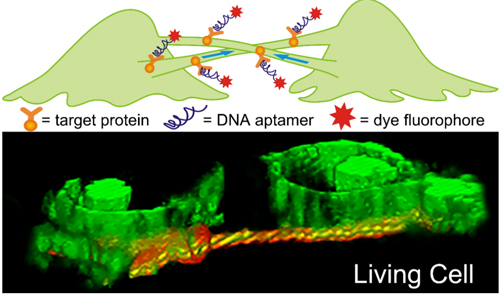
图2 核酸适配体识别细胞胞间隧道纳米管类似结构的示意图和活细胞成像图
活体分析化学院重点实验室
2016年12月15日
附件下载: