

化学所在自组装药物新策略提高抗癌药物疗效研究方面取得新进展
化疗是目前治疗恶性肿瘤最重要的手段之一,但是,化疗药物对正常组织的毒副作用以及肿瘤耐药性成为目前提高恶性肿瘤治疗效果和预后的主要障碍。随着纳米技术的发展,药物与载体制成的纳米药物因其独特的尺寸效应与表面效应可明显提高癌症疗效而备受关注,但是肿瘤自身特殊的结构特征,尤其是肿瘤微环境的乏氧、酸性、免疫抑制和细胞因子异常等特征,导致现有的纳米药物还无法达到对肿瘤高效、低毒的治疗效果。
在国家自然科学基金委和中国科学院的支持下,中科院化学所有机固体院重点实验室王树研究员课题组针对上述难题提出了肿瘤微环境响应的药物分子细胞内原位组装的超分子化疗新思路。设计、合成了一种新型共价连接p共轭寡聚分子与巯基的紫杉醇体系(OPV-S-PTX),通过细胞内选择性的原位自组装技术提高了紫杉醇疗效,降低毒性并克服了耐药性。该分子通过π-π堆叠和疏水相互作用聚集,进一步在活性氧(ROS)作用下通过二硫键交联在肿瘤细胞内原位组装形成纳米聚集体,从而阻止排除细胞外。实验结果表明OPV-S-PTX的IC50相比PTX本身降低124倍,即使对紫杉醇耐药的肿瘤细胞株A549/T,IC50也降低90倍。裸鼠实验表明肿瘤的生长受到明显抑制。由于正常哺乳动物细胞中ROS活性较低,不能有效诱导OPV-S-PTX在细胞内组装,因此该体系对正常细胞几乎无毒性。对其增强抗肿瘤作用的分子机制进行了探讨,OPV-S-PTX可极大促进微管束在肿瘤细胞的形成,导致细胞凋亡。该研究成果发表于Adv. Mater.2018, 30, 1704888。在此研究基础上,将长春新碱(Vin)、他莫昔芬(TMX)、替尼泊苷(Tenip)和阿霉素(Dox),通过迈克尔加成反应分别制备得到OPV-S-Vin、OPV-S-TMX、OPV-S-Tenip和OPV-S-Dox。实验结果表明这些OPV-S-Drug均可在肿瘤细胞内组装形成药物聚集体,与单独药物分子相比,OPV-S-PTX、OPV-S-TMX与OPV-S-Vin对耐药的肿瘤细胞系IC50值降低5~8倍,获得了较好的抗癌效果。由于替尼泊苷和阿霉素是结合DNA的拓扑异构酶抑制剂,OPV-S-Dox和OPV-S-Tenip不能穿透核膜,因此活性被抑制。OPV-S-Drug在肿瘤细胞内与靶点的作用模式决定它们的药效(见图)。将细胞内原位组装的策略用于选择性差、高毒性的表鬼臼毒素(Podophyllotoxin),OPV-S-Podo不但保留了表鬼臼毒素对肿瘤细胞高效杀伤的活性,而且对正常细胞的毒性显著降低。通过细胞内原位自组装技术可提高药物分子在肿瘤部位的靶向富集,抑制肿瘤细胞内药物外排,并降低对正常细胞的毒副作用,为发展高效、低毒的化疗药物提供了一条有效途径。该研究成果近日以全文的形式发表在中国化学会旗舰期刊《CCS Chemistry》创刊号,CCS Chemistry2019, 1, 97-105。文章第一作者为周凌云博士,通讯作者为吕凤婷副研究员。
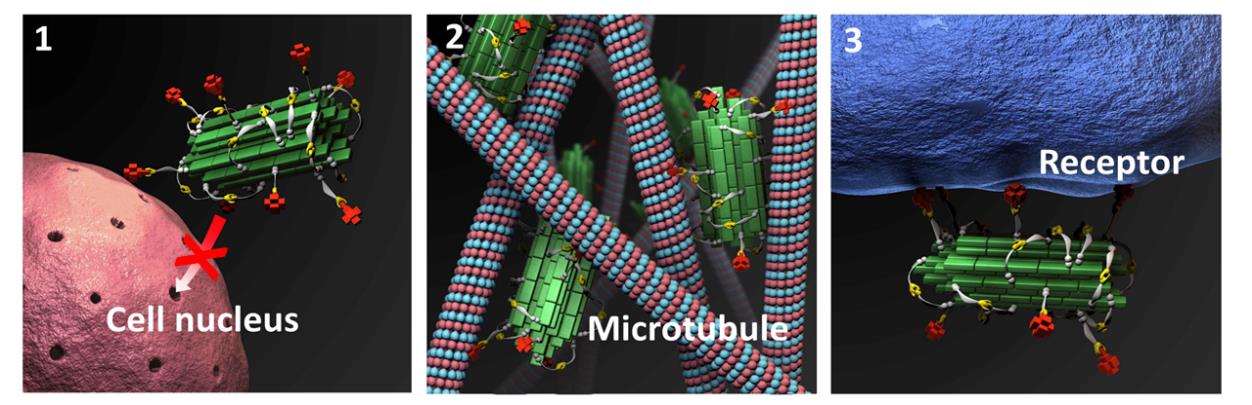
OPV-S-Drug在肿瘤细胞内作用模式:1. OPV-S-Dox和OPV-S-Tenip不能穿透核膜,药效被抑制;2. OPV-S-PTX,OPV-S-Vin和OPV-S-Podo与微管多价结合诱导细胞凋亡;3. OPV-S-TMX与雌激素受体相互作用诱导细胞凋亡
有机固体院重点实验室
2019年4月18日
附件下载: