

汪铭课题组发展CRISPR/Cas9递送及活体基因编辑新策略
CRISPR/Cas9是一种源自细菌获得性免疫系统的基因编辑技术,在化学生物学基础研究及发展新型基因治疗技术中具有广泛的应用前景。然而,其生物医学应用面临的关键问题之一在于递送具有基因编辑功能的Cas9核酸酶进入细胞中,并实现活体基因编辑。
最近,在国家自然科学基金委、科技部和中国科学院的支持下,汪铭课题组通过设计阳离子脂质体与Cas9信使RNA (Cas9 mRNA)之间的分子自组装制备了Cas9 mRNA纳米颗粒,并进一步应用于CRISPR/Cas9的递送及活体基因编辑。研究人员首先设计了苯硼酸修饰的阳离子脂质体载体,利用其与细胞膜表面唾液酸(sialic acid)之间的靶向性识别作用,以及疾病细胞表面高表达唾液酸化蛋白的特点,实现了细胞系选择性Cas9 mRNA递送及靶向基因编辑 (ACS Applied Materials & Interfaces, 2019, 11, 46585-46590.)。
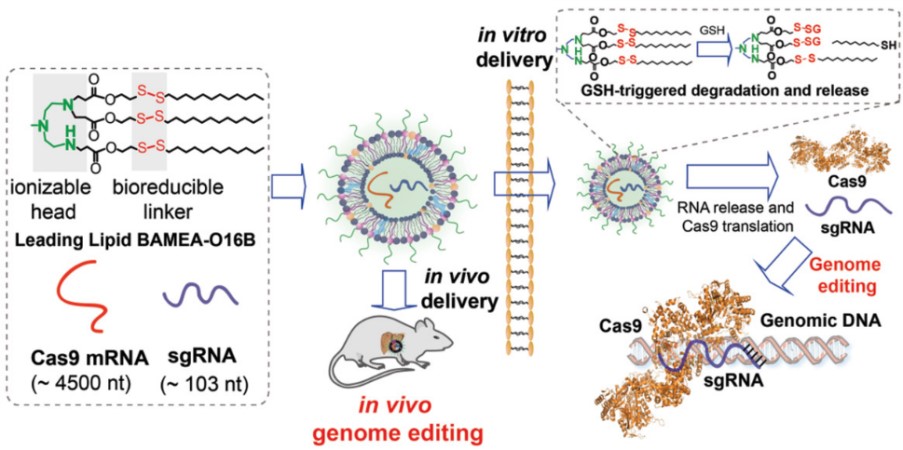
在上述基础上,进一步设计了细胞微环境可降解的阳离子脂质体载体,实现了高效的Cas9 mRNA递送和活体基因编辑。研究表明,上述mRNA纳米颗粒进入细胞后,可在胞内还原性谷胱甘肽(reduced Glutathione)的作用下发生降解,释放Cas9 mRNA并翻译Cas9 核酸酶进行基因编辑。利用脂质体BAMEA-O16B递送Cas9 mRNA可有效编辑报告信号蛋白的表达(GFP基因编辑效率高达90%),而通过尾静脉注射的BAMEA-O16B/Cas9 mRNA纳米颗粒可在小鼠肝实质细胞中富集,并调控前蛋白转化酶枯草杆菌蛋白酶kexin9型(PCSK9,一种介导体内低密度脂蛋白及胆固醇代谢的相关基因)的表达。单次注射BAMEA-O16B/Cas9 mRNA纳米颗粒可使小鼠血清中PCSK9蛋白水平下降达80%以上。相关研究成果近期发表于Adv. Mater.2019,31, 1902575,博士研究生刘计为第一作者,论文发表后同时被新华网作为研究亮点进行报道。
活体分析化学院重点实验室
2019年12月26日
附件下载: