

汪铭课题组发展细胞选择性CRISPR/Cas9基因编辑工具
CRISPR/Cas9是源自细菌获得性免疫系统的新一代基因编辑技术,在化学生物学、生物医学及基因治疗中具有潜在应用前景。CRISPR/Cas9技术使用引导RNA(single-guide RNA,sgRNA)识别靶标基因,并招募Cas9核酸酶对基因组进行切割、编辑等操作。然而,由于sgRNA识别基因组存在非特异性结合作用,现有CRISPR/Cas9技术应用于基因编辑时存在一定的脱靶效应,且缺乏对疾病细胞的选择性,限制了其在化学生物学领域的应用。
在科技部、基金委和中国科学院的支持下,化学所活体分析化学院重点实验室汪铭课题组围绕可控及细胞选择性CRISPR/Cas9技术开展研究,发展了酶诱导的CRISPR系统(enzyme-inducible CRISPR, eiCRISPR),实现了细胞选择性基因编辑。eiCRISPR由三部分组成,包括Cas9核酸酶、自封闭失活的引导RNA(bsgRNA)以及化学修饰的脱氧核酶DNAzyme,其中DNAzyme可特异性降解bsgRNA的自封闭区进而激活CRISPR系统。为了实现可控及细胞选择性基因编辑,他们通过设计优化DNAzyme磷酸骨架的化学修饰,抑制了其降解bsgRNA自封闭区的能力。而外源性光信号、内源性化学微环境(如细胞内活性氧、NQO1酶)等可选择性触发化学修饰DNAzyme的脱笼反应,激活DNAzyme并降解bsgRNA的自封闭区,进而激活eiCRISPR系统。进一步,研究人员利用课题组发展的可降解脂质纳米颗粒(LNP)递送系统,实现了细胞及活体层次eiCRISPR的高效递送和在体激活。研究发现,eiCRISPR可在肿瘤组织中被选择性激活,并编辑、敲低人乳头瘤病毒18(HPV18)E6基因,从而用于潜在的肿瘤治疗。该方法为解决CRISPR/Cas9技术中面临的基因编辑脱靶效应以及缺乏疾病靶向性等挑战提供了新策略。该研究工作近期发表于J. Am. Chem. Soc.(2022, 144, 22272-22280),论文第一作者为博士研究生蔡玮琦,通讯作者为汪铭研究员。
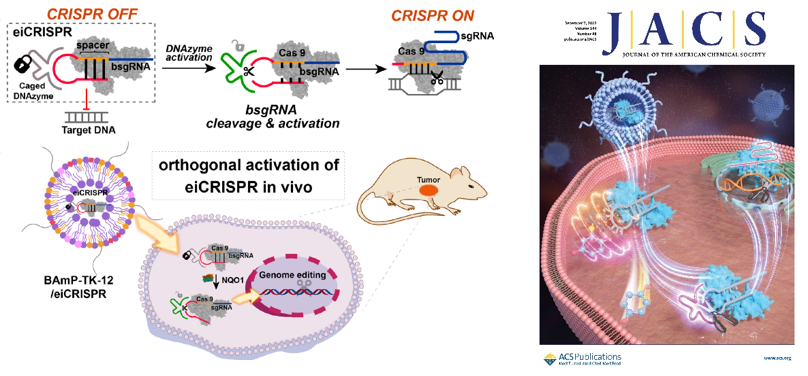
图. 酶促反应激活的细胞选择性CRISPR/Cas9基因编辑系统
活体分析化学院重点实验室
2022年12月26日
附件下载: