

肖海华课题组在纳米诊疗体系构建及其抗肿瘤机制研究方面取得新进展
肿瘤转移被认为是癌症相关死亡的主要原因。光动力疗法(PDT)作为一种新兴的肿瘤治疗方法,具有时空可控性强、副作用小等优点,可进一步诱导免疫原性细胞死亡,触发生物体的全身免疫反应,有效抑制原发性肿瘤和转移性肿瘤。光敏剂是PDT的核心要素,目前开发的光敏剂仍有水溶性差、光稳定性不足和选择性差等缺点。为此,近年来许多研究工作致力于开发具备成像功能的光敏剂,构建多功能靶向诊断治疗系统,以便改善光敏剂的水溶性、提高光稳定性、增加选择性,最终跟踪纳米颗粒在体内的分布,并对肿瘤进行定位。尽管大量的PDT相关研究工作被报道,但其究竟主要通过哪些重要信号通路发挥作用至今尚不清晰。因此,探究肿瘤治疗PDT的核心通路十分关键。
在国家自然科学基金委、科技部国家重点研发计划等项目的支持下,化学研究所高分子物理与化学实验室肖海华课题组近年来紧紧围绕生物医用材料和生物安全材料的研究主题,提出了“进化纳米医学”的研究新思路,开展了“纳米药物的多组学研究”和“靶向肿瘤进化的创新纳米药物”的创新研究探索,在铂类药物载体设计(Nat. Biomed. Eng. 2021, 5, 1048)、精准递送(Adv. Mater. 2023, 35, 2210267)、示踪成像(Adv. Mater. 2022, 34, 2203820)、可控还原(Angew. Chem. Int. Ed. 2022, 61, e202201486)、协同增敏(Adv. Mater. 2023, 2212267; Angew. Chem. Int. Ed. 2022, 61, e202203546)、抑制耐药(Angew. Chem.Int. Ed. 2023, e202300662; Adv. Mater. 2022, 34, 2105976; Adv. Mater. 2021, 33, 2100599)等方面取得了系列研究进展。
最近,该课题组与合作者发展了新型可降解高分子纳米诊疗系统,并用于肿瘤的光动力治疗和免疫治疗。通过在荧光成像分子和光敏剂分子中分别引入羟基官能团,可进一步借助缩合聚合反应,获得主链含有荧光分子、光敏剂的可降解聚合物(图a)。该聚合物具有两亲性,在水溶液中可分别自组装成纳米颗粒。为了获得诊疗一体化的纳米颗粒,研究人员将上述两种纳米材料等摩尔混合即可获得复合纳米颗粒(Comp-NPs)(图b)。Comp-NPs经过静脉注射通过EPR效应被动靶向至肿瘤部位,通过光动力疗法和免疫疗法可诱导全身免疫反应,从而抑制肿瘤生长。通过蛋白质组学研究,他们发现Comp-NPs抑制了mTOR 及其下游P70s6k信号通路,该通路参与肿瘤演变、复发以及转移等关键过程(图c)。利用转移性乳腺癌PDX小鼠和肝癌PDX小鼠模型,他们还发现Comp-NPs可抑制原发肿瘤的生长并防止肿瘤发生转移。相关研究成果近期发表在Nat. Commun.14, 5350 (2023),论文第一作者为周惠玲硕士和博士生唐东升,通讯作者为德国波鸿鲁尔大学Johannes Karges教授和化学研究所肖海华研究员。
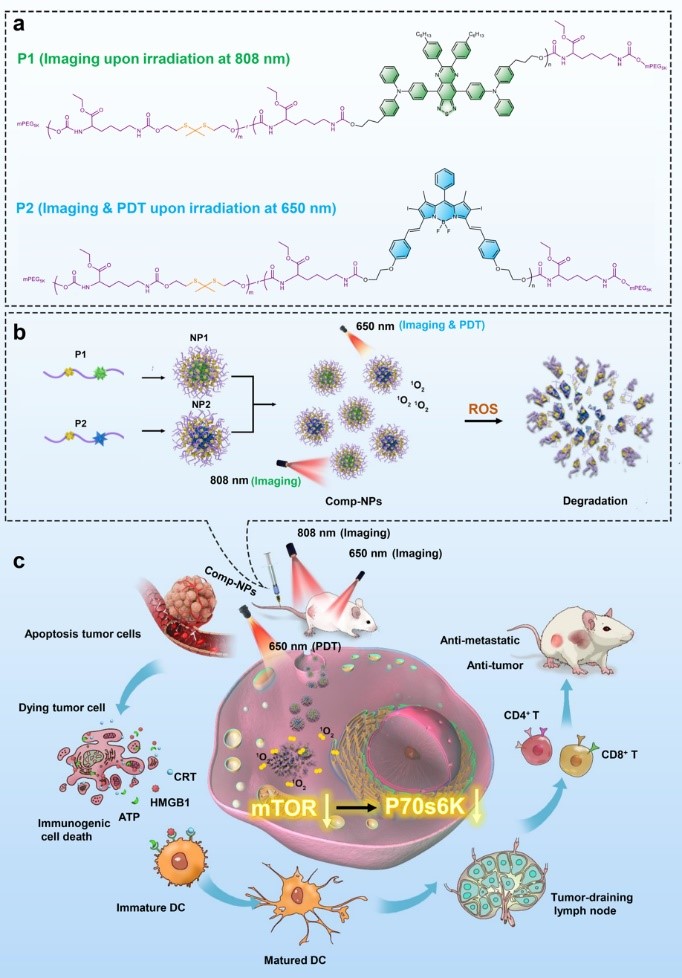
图. 具有肿瘤光动力治疗和免疫治疗功能的Comp-NPs 纳米诊疗系统及其作用机制示意图
高分子物理与化学实验室
2023年9月13日
附件下载: