

汪铭课题组在时空特异性蛋白质递送及基因编辑研究方面取得新进展
蛋白质是生命体内最重要的生物大分子之一,在生命活动过程中执行着多种关键功能。利用外源性获取的蛋白质,可以在细胞及体内实现生物大分子的化学标记及功能调控,进而应用于生命机制的解析及疾病的靶向治疗。然而,由于蛋白质本质上具有亲水性,其难以自主穿透疏水性细胞膜到达胞内靶点,并实现特定器官组织的靶向。因此,发展细胞及活体层次递送蛋白质的方法与技术对于蛋白质化学生物学及生物医学研究具有重要意义。
在国家自然科学基金委、中国科学院和北京市自然科学基金的支持下,化学研究所活体分析化学院重点实验室汪铭课题组围绕蛋白质递送及功能干预开展研究,先后发展了系列可在细胞及活体层次递送蛋白质及CRISPR/Cas9基因编辑器的方法(Acc. Chem. Res. 2024, 57, 208-221; Angew. Chem. Int. Ed. 2024, 63, e202400926.)。然而,如何实现组织器官靶向的时空特异性蛋白质递送依然面临挑战。
近期,该课题组通过设计金属配位超分子(metal-organic cages,MOC)的层级自组装,并利用蛋白质表面氨基酸的氢键作用,成功构建了具有组织特异性的超分子纳米颗粒(LSNPs),发展了时空特异性蛋白质递送新方法,能够有效靶向肝脏、肺等组织。分子机制研究表明,MOC与蛋白质组装形成的LSNPs的表界面化学特性影响其在体内循环过程中吸附血清蛋白形成的表面蛋白冠的组成,进而影响蛋白质递送的组织特异性。其中,玻连蛋白(vitronectin,Vtn)与整合素αvβ3的识别作用介导了LSNPs的肺部特异性。利用上述原理,他们进一步发展了时空特异性基因编辑器递送方法,通过CRISPR/Cas13d RNA编辑技术实现了对肺部病毒感染相关基因-组织蛋白酶L的靶向干预。
相关研究成果近期发表于Proceedings of the National Academy of Sciences of the United States of America(PNAS, 2024, 121, e2406654121.)。论文第一作者为博士后刘计,通讯作者为汪铭研究员。
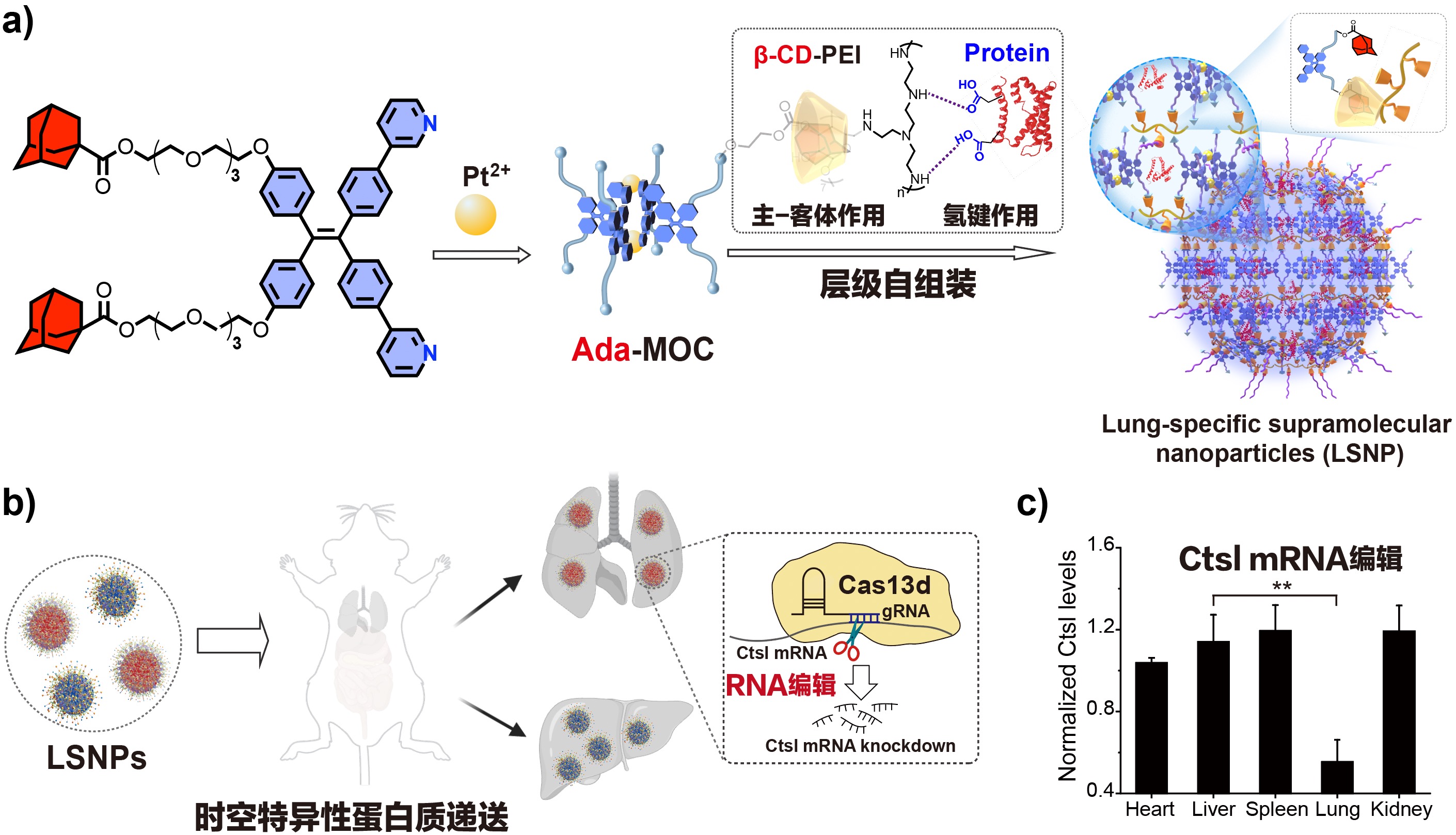
时空特异性蛋白质递送示意图及组织特异性CRISPR/Cas13d RNA编辑应用
活体分析化学院重点实验室
2024年8月22日
附件下载: